Sebelum kita masuk ke materi, apakah kamu sudah paham mengenai larutan elektrolit dan non elektrolit sebelumnya ? bagaiamana dengan materi ikatan kimia kamu ? apakah kamu masih mengingat nya ? menurut kamu dimana ya ada hubungan keelektrolitan dengan ikatan kimia nya ? yuk kita langsung masuk kemateri nya.
Hubungan Keelektrolitan Dengan Ikatan kimia
sifat elektrolit dari suatu larutan sangat bergantung pada jenis ikatan dari senyawa yang membentuk larutan tersebut. Larutan elektrolit dapat bersumber dari senyawa ion (senyawa yang mempunyai ikatan ion) atau senyawa kovalen polar (senyawa yang mempunyai ikatan kovalen polar)
a. Senyawa Ion
Salah satu contoh larutan yang tergolong larutan elektrolit yang berikatan ion adalah larutan garam dapur. Dalam larutannya, garam dapur dapat menghantarkan listrik. Namun bagaimanakah daya hantar listrik garam dapur dalam keaadan kristal dan lelehan ? NaCl adalah senyawa ion yang dalam keadaan kristal sudah sebagai ion ion. (quadra)
Senyawa ion dibentuk oleh perpindahan elektron diantara atom untuk membentuk partikel yang bermuatan listrik dan mempunyai gaya tarik-menarik. Senyawa ion terdiri atas ion-ion misalnya NaCl dan NaOH. NaCl terdiri atas ion-ion Na+ dan Cl-, sedangkan NaOH terdiri atas ion-ion Na+ dan OH-. Dalam kristal (padatan) ion-ion tidak dapat bergerak bebas, melainkan diam pada tempatnya. Oleh karena itu, padatan senyawa ion tidak menghantarkan listrik. Akan tetapi, jika senyawa ion dilebihkan atau dilarutkan maka ion-ionnya tidak bergerak bebas, sehingga lelehan dan larutan ion dapat menghantarkan listrik. (micahel purba)
Ketika senyawa ionik seperti natrium klorida larut dalam air, jaringan tiga demensi dari ion-ion dalam padatan akan rusak dan ion-ion Na+ dan Cl- terpisahkan satu sama lain. Dalam larutan, setiap ion Na+ dikelilingi oleh sejumlah molekul air yang mengarahkan ujung negatifnya kearah kation. Hal yang serupa, setiap ion Cl- dikelilingi oleh molekul air yang ujung positifnya diarahkan pada anion. (james brady)
Reaksi pelarutan NaCl Paadat didalam air menghasilkan ion-ion Na dan ion ion Cl- yang masing masing berikatan dengan molekul molekul air
b. Ikatan Kovalen
Tahukah kamu bahwa senyawa kovalen terbagi menjadi dua, yaitu kovalen polar dan kovalen non polar. Contoh kovalen polar adalah HCl, HBr, HI dan NH3,. Sementara itu contoh senyawa ikatan kovalen non polar adalah H2, F2 , Cl2, I2. (quadra)
Ikatan kovalen polar terbentuk dari pemakaian bersama elektron diantara atom-atom. Dengan perkataan lain, gaya tarik menarik inti atom pada elektron yang dipakai bersama diantara elektron itu merupakan suatu ikatan kovalen. Molekul bersifat netral dan tidak dapat menghantarkan listrik. Sebagian molekul bersifat polar, misalnya molekul-molekul air, sedangkan sebagian lain bersifat nonpolar, misalnya CH4. Oleh karena bersifat polar, maka air kita disebut sebagai pelarut polar. (michael purba)
Berbagai zat molekul polar, seprti HCl dan CH3COOH, jika dilarutkan dalam air, dapat mengalami ionisasi sehingga larutannya dapat menghantarkan listrik. Hal itu terjadi karena antara molekul tersebut terdapat suatu gaya tarik menarik yang dapat memutuskan ikatan tertentu dalam molekul tersebut.
Perhatikan kembali ionisasi
HCl dan CH3COOH berikut:
HCl(g) + air → H+(aq) + Cl-(aq)
CH3COOH(I) → CH3COO-(aq) + H+(aq)
CH3COOH(I) → CH3COO-(aq) + H+(aq)
Meskipun demikian tidak semua molekul polar dapat mengalami ionisasi dalam air. Molekul nonpolar, sebagaimana dapat diduga, tidak ada yang bersifat elektrolit. (michael purba)
perbedaan sifat elektrolit senyawa ion, senyawa kovalen polar dan senyawa kovalen non polar.




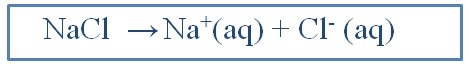

0 Response to "Hubungan Keelektrolitan Dengan Ikatan kimia "
Posting Komentar